Marcos Aurélio Barboza de OliveiraI; Lívia Carvalho FerreiraII; Débora Aparecida Pires de Campos ZuccariII; Antônio Carlos BrandiIII; Carlos Alberto dos SantosIII; Paulo Henrique Husseni BotelhoIII; Orlando PetrucciIV; Domingo M BraileV
DOI: 10.5935/1678-9741.20140015
ATP: Trifosfato de adenosina
BSA: Soro fetal bovino
DOM: Densidade óptica média
HTG: Histidina-triptofano-glutamato
HTK: Histidina-triptofano-cetoglutarato
IL: Interleucina
IP: Intraperitoneal
UA: Unidades arbitrárias
INTRODUÇÃO
A indução da parada temporária do coração durante a cirurgia cardíaca é um procedimento relativamente comum que permite ao cirurgião realizar procedimentos em ambiente isento de sangue e movimento [1-3]. Um dos agentes cardioplégicos utilizados é a solução histidina-triptofano-cetoglutarato (HTK).
O HTK foi testado por Bretschneider et al. [4], na Alemanha, em 1975. Seu mecanismo de ação vem da ausência do cálcio, que evita seu influxo para o interior da célula pelos canais de cálcio tipo "L" na fase de platô do potencial de ação, inibindo a liberação de mais cálcio do retículo sarcoplasmático do miócito, resultando na inativação dos miofilamentos [5,6].
Esse mecanismo é complementado pela proteção celular dada pelos constituintes dessa solução, cujas funções principais incluem: 1- histidina: sistema tampão dependente de temperatura, inibidor de metaloproteinases de matriz e impermeante celular [7]; 2- triptofano: atua na manutenção da integridade da membrana celular [8] e, 3- cetoglutarato: melhora pressão máxima desenvolvida e evita aumento da fração MB da creatinofosfoquinase [8].
Segundo Pisarenko et al. [9], a substituição do alfacetoglutarato pelo glutamato traria algumas vantagens para o miócito: a diminuição do lactato e a elevação do pH na matriz mitocondrial, mesmo em isquemia, evitando a acidose intracelular e o edema, contribuindo para a manutenção do trifosfato de adenosina (ATP) intracelular, protegendo o miócito da lesão de isquemia-reperfusão.
Por sua vez, a redução da lesão de reperfusão provocaria diminuição da caspase [10-12] e da IL-8, devido à redução da apoptose e da necrose celular, respectivamente [13,14]. Entretanto, a diminuição da lesão de reperfusão pode não estar atuando sozinha em benefício ao miócito. Proteínas proliferativas, como o KI-67, poderiam voltar a serem codificadas, contribuindo para a redução da morte celular e mesmo formação de novas fibras miocárdicas [15,16].
Este trabalho objetiva avaliar solução de HTG como agente cardioplégico em coração isolado de ratos, considerando análise imuno-histoquímica dos marcadores caspase, IL-8 e KI-67.
MÉTODOS
Após aprovação do Comitê de Ética em Experimentação Animal da Faculdade de Medicina de São José do Rio Preto (autorização número 015/2012), foram utilizados 20 ratos (10 para cada grupo), machos, raça Wistar, com peso médio de 280±29 gramas.
Todos os animais receberam cuidados conforme recomendações do Committee on Care and Use of Laboratory Animals - Institute of Laboratory Animal Resources (ILAR) - National Research Council, Estados Unidos [17].
Protocolo Experimental
Os animais foram anestesiados com injeção de 65 mg/kg intraperitoneal de pentobarbital sódico e receberam heparinização sistêmica IP (500 UI/kg). Após a abertura do tórax, foi realizada cardiectomia. Os corações receberam solução de Ringer lactato para "lavar" a árvore coronariana e, em seguida, solução cardioplégica conforme seu grupo.
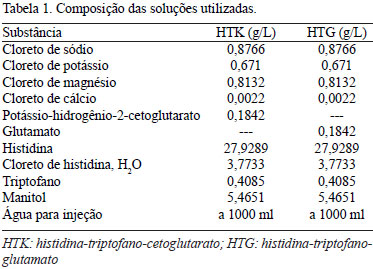
Os corações nessa fase do experimento foram divididos em 2 grupos. No grupo 1, foi utilizada solução de HTK a 4ºC e, no grupo 2, solução de histidina-triptofano-glutamato (HTG) a 4ºC. A Tabela 1 apresenta a composição de cada uma das soluções. Em todos os casos, a infusão da cardioplegia foi feita em dose única de 40 ml/kg na raiz da aorta, seguida por imersão do órgão na mesma solução por 2 horas a 4ºC.
Após esse tempo, os corações foram colocados em sistema de Langendorff e perfundidos com solução tampão de Ringer Locke oxigenado, em normotermia e pressão constante de 100 cm H2O, por método gravitacional durante 30 minutos. A drenagem do ventrículo direito foi realizada pela abertura da artéria pulmonar, sendo mantido intacto o átrio direito no intuito de preservar o nó sinusal [18].
Foram inseridos três fios de marca-passo epicárdico em pontos equidistantes dos ventrículos para documentação eletrocardiográfica dos eventos cardíacos. Foi anotado o tempo de início da fibrilação ventricular e o primeiro batimento cardíaco contado a partir do início da infusão da solução de Ringer Locke.
Após 30 minutos de infusão de Ringer Locke, o experimento foi descontinuado. Os corações foram retirados do sistema de Langendorff, sendo coletados fragmentos de ápice cardíaco, que foram armazenados em tubos estéril tipo Falcon contendo formol 10%, para posterior preparação histólogica e imuno-histoquímica.
Preparação histológica e técnica imuno-histoquímica
Inicialmente, o material foi incluído em parafina, procedimento que oferece resistência permitindo seu corte em espessura de 3 µm e colocados em lâminas silanizadas. A silanização das lâminas consistiu na preparação destas com um adesivo que fixa o fragmento às lâminas, impedindo seu descolamento durante o procedimento imuno-histoquímico. Para tanto, estas foram imersas em acetona PA (2 minutos), solução de silano 4% diluído com acetona (2 minutos) e novamente em acetona PA (4 a 5 mergulhos). A secagem das lâminas foi realizada na estufa a 60ºC.
O bloco foi preso ao micrótomo, a espessura do corte foi regulada para 3 µm e os cortes colocados em lâmina silanizada identificada e deixados na estufa a 60ºC por 24 horas. As lâminas passaram pelo processo de desparafinização em xilol, seguida por hidratação em álcool absoluto I, II e III, finalizando com seis mergulhos em água corrente, incubados com 3% de peróxido de hidrogênio por 30 minutos para o bloqueio da peroxidase endógena.
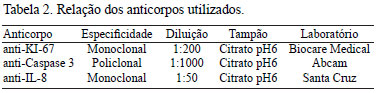
A recuperação antigênica foi realizada na panela a vapor com tampão específico para cada anticorpo por 30 minutos (Tabela 2). Em seguida, as lâminas foram encobertas com solução contendo soro fetal bovino (BSA) e incubadas com o anticorpo primário.
Após essa etapa, as lâminas foram lavadas em solução PBS por 15 minutos e incubadas com kit Starr Trek Universal HRP Detection (Biocare Medical®), que consistiu no anticorpo secundário biotinilado por 1 hora e no complexo estreptavidina-peroxidase por 30 minutos, seguidas de lavagem com PBS por 15 minutos. A revelação foi feita com substrato cromógeno (Betazoidchromogen DAB) do kit Starr Trek Universal HRP Detection (Biocare Medical®) de 2 a 5 minutos e a contracoloração com hematoxilina de Harrys por 40 segundos. Os tecidos foram desidratados em álcool em grau crescente e banhados no xilol antes da montagem das lâminas em meio ERV-MOUNT (Erviegas®).
Os controles negativos das reações foram obtidos pela omissão do anticorpo primário. Foram utilizados tecido de tonsila para reações de KI-67 e caspase 3 e como controle positivo tecido de mama para reação de IL-8.
Quantificação da marcação imuno-histoquímica
As lâminas foram fotografadas e as enzimas quantificadas pelo software AxioVision no aumento de 40X do microscópio Axioskop 2 Zeiss. Para cada amostra, foram selecionadas três regiões do tecido cardíaco e 20 pontos das células miocárdicas foram marcados em cada região. Assim, foram analisados 60 pontos diferentes de cada amostra, obtendo a média da intensidade relativa de imunorreatividade. Os valores foram obtidos em unidades arbitrárias (UA). A densidade óptica média (DOM) foi obtida com a ajuda da fórmula:
DOM = 255 - UA
Essa fórmula demonstrou a intensidade da imunocoloração especificamente nas áreas imunorreativas.
Análise estatística
Os dados obtidos foram submetidos ao teste de normalidade de Kolmogorov-Smirnov e, subsequentemente, a análise paramétrica pelo teste t de Student não pareado ou não paramétrica pelo teste de Mann-Whitney, quando adequado, e teste exato de Fisher para dados categóricos. Os resultados foram expressos somente em média ± desvio padrão devido ao fato de todas as variáveis se comportarem como quantitativas contínuas com distribuição Gaussiana. Os valores de P foram apresentados, sendo que aqueles que foram menores que 0,05 foram considerados significantes. Utilizou-se o programa de cálculos estatísticos GraphPad Instat e Prism 6.0, ambos para Windows®.
RESULTADOS
O peso médio dos animais foi 277,4±24,6 g (grupo 1) e 288±34,5 g (grupo 2), respectivamente, não havendo diferença significante entre os grupos (P=0,4396). Com relação ao volume médio de Ringer Locke coletado de seio coronário ao final de 30 minutos (363,1±177,3 ml e 277,4±33,7 ml, respectivamente), não houve diferença significante entre os grupos (P=0,1923).
Achados durante perfusão com solução cardioplégica e Ringer Locke
Todos os corações apresentaram perfusão adequada de cardioplegia e Ringer Locke, evidenciada pela coloração clara na parede ventricular. A frequência cardíaca média, após 5 minutos de perfusão (233±36 e 188±53,4 batimentos por minuto, respectivamente), apresentou diferença significante (P=0,0086). O tempo de início de fibrilação ventricular (49±28,2 e 45±17 segundos, respectivamente) e o tempo de primeiro batimento (153±78 e 117±96,8 segundos, respectivamente) não demonstraram diferença significante (P=0,5869 e P=0,187, respectivamente).
Achados imuno-histoquímicos
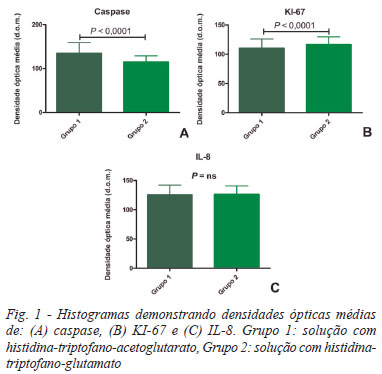
Após 2 horas de isquemia e 30 minutos de reperfusão, a atividade da caspase foi significativamente menor no grupo 2 (P<0,0001), a atividade de KI-67 foi maior no grupo 2 (P<0,0001) e a da IL-8 não foi diferente entre os grupos (Figura 1).
DISCUSSÃO
Isquemia miocárdica causa diversos efeitos cardíacos, tais como: diminui força de contração; aumenta pressão diastólica, indicando contratura das miofibrilas em condições isovolumétricas; provoca queda na fosfocreatina e ATP; diminui a contratura, glutamato e aspartato e; aumenta lactato, piruvato, alanina e succinato [9]. Segundo Pisarenko et al. [9], a adição de glutamato no perfusato mantém o ATP intracelular e diminui tanto o lactato quanto o piruvato, que contribuiriam para acidose. Esses efeitos contribuem para melhorar a função cardíaca na recuperação após isquemia. Nossos resultados demonstram comportamento semelhante nas duas soluções estudadas referentes ao tempo de fibrilação ventricular e tempo de primeiro batimento, entretanto foi melhor para grupo 2 para frequência cardíaca, que se encontrava mais baixa, o que pode ser correlacionado provavelmente com menor acidose do miócito.
Outro processo que está intrinsecamente relacionado com lesão isquemia-reperfusão é a apoptose [10,11], caracterizada por alterações morfológicas, como condensação da cromatina, fragmentação do núcleo e formação de "corpos apoptóticos". Essas mudanças são feitas por uma família de proteases denominadas caspases [12]. O grau de ativação das caspases é diretamente relacionado ao grau de apoptose, que desempenha fator crítico na recuperação da função cardíaca [13]. Nossos resultados demonstram atividade de caspase menor no grupo 2, sugerindo um potencial protetor para função miocárdica.
Em contraste com a apoptose, a necrose é um processo irreversível de morte celular em consequência à quebra na homeostase celular. Há ruptura da membrana celular, com extravasamento do citosol ao meio extracelular, marginação leucocitária e ativação da cascata inflamatória [13,14]. Anselmi et al. [14] descreveram pico da IL-8 em 35 minutos de reperfusão e da IL-6 em 75 minutos. Lee et al. [13] afirmaram que a solução de HTK inibe aumento das interleucinas. Assim, como nesta pesquisa não houve diferença significativa da IL-8 entre os grupos 1 e 2, podemos inferir que a proteção anti-inflamatória dada pela solução HTG não foi diferente daquela dada pela solução HTK.
Corações de mamíferos apresentam pequena capacidade proliferativa após o nascimento. Um dos marcadores utilizados para avaliar proliferação celular é o KI-67 [15]. Com esse marcador, Walsh et al. [16] demonstraram que 12% a 23% dos cardiomiócitos fetais de ratos apresentam atividade proliferativa, passando a 1% a 8% até o 7º dia e praticamente indetectável a partir do 14º dia. Em nosso estudo, houve aumento significativo do KI-67 no grupo 2, demonstrando atividade proliferativa precoce da solução HTG garantida já com 2 horas de isquemia. Associado a isso, Walsh et al. [16] também chamam a atenção da atividade do KI-67 também ser inversamente proporcional à apoptose, o que também é confirmado em nosso estudo, no qual a caspase é menor no grupo 2 que no 1. Entretanto, o aumento da atividade desse marcador é preocupante, pois já foi associado a mixomas [19,20] e sarcomas cardíacos [21].
Apesar dos resultados aqui obtidos serem concordantes com os da literatura, ainda não são definitivos em relação à substituição do alfacetoglutarato pelo glutamato. Análises quantitativas com ATP e outros marcadores nucleares para proliferação celular devem ser utilizados visando a uma conclusão mais abrangente e segura. Outro aspecto relevante é a concentração do glutamato. Teria o mesmo efeito protetor no coração se alterarmos sua concentração? Novos estudos ainda são necessários para responder essas questões.
CONCLUSÃO
A análise imuno-histoquímica da substituição do alfacetoglutarato pelo glutamato na cardioplegia com histidina e triptofano demonstrou que as células musculares cardíacas não apresentaram maior ocorrência de necrose, visto pela mensuração da IL-8, apresentaram menor ocorrência de apoptose, confirmado pelos valores mais baixos da caspase no grupo 1 e melhor atividade proliferativa, com valores maiores da KI-67 em relação ao grupo 1. Isso sugere que a solução HTG foi mais eficiente que a HTK na preservação dos cardiomiócitos dos corações de ratos.
REFERÊNCIAS
1. Chambers DJ. Mechanisms and alternative methods of achieving cardiac arrest. Ann Thorac Surg. 2003;75(2):S661-6. [MedLine]
2. Fannelop T, Dahle GO, Matre K, Moen CA, Mongstad A, Eliassen F, et al. Esmolol before 80 min of cardiac arrest with oxygenated cold blood cardioplegia alleviates systolic dysfunction. An experimental study in pigs. Eur J Cardiothorac Surg. 2008;33(1):9-17. [MedLine]
3. Braile DM, Ardito RV, Zaiantchick M, Santos JLV, Soares MJF. Cardioplegia sanguínea contínua normotérmica. Rev Bras Cir Cardiovasc. 1989;4(2):109-38. Visualizar artigo
4. Bretschneider HJ, Hübner G, Knoll D, Lohr B, Nordbeck H, Spieckermann PG. Myocardial resistance and tolerance to ischemia: physiological and biochemical basis. J Cardiovasc Surg (Torino). 1975;16(3):241-60. [MedLine]
5. Fallouh HB, Kentish JC, Chambers DJ. Targeting for cardioplegia: arresting agents and their safety. Curr Opin Pharmacol. 2009;9(2):220-6. [MedLine]
6. Chambers DJ, Hearse DJ. Developments in cardioprotection: "polarized" arrest as an alternative to "depolarized" arrest. Ann Thorac Surg. 1999;68(5):1960-6. [MedLine]
7. Antunovic M, Aleksic D. Preparation and testing of solutions for organ perfusion and preservation in transplantation. Vojnosanit Pregl. 2008;65(8):596-600. [MedLine]
8. Hachida M, Ookado A, Nonoyama M, Koyanagi H. Effect of HTK solution for myocardial preservation. J Cardiovasc Surg (Torino). 1996;37(3):269-74. [MedLine]
9. Pisarenko OI, Solomatina ES, Ivanov VE, Studneva IM, Kapelko VI, Smirnov VN. On the mechanism of enhanced ATP formation in hypoxic myocardium caused by glutamic acid. Basic Res Cardiol. 1985;80(2):126-34. [MedLine]
10. Xu YJ, Saini HK, Zhang M, Elimban V, Dhalla NS. MAPK activation and apoptotic alterations in hearts subjected to calcium paradox are attenuated by taurine. Cardiovasc Res. 2006;72(1):163-74. [MedLine]
11. Fischer UM, Cox CS Jr, Laine GA, Mehlhorn U, Bloch W, Allen SJ. Induction of cardioplegic arrest immediately activates the myocardial apoptosis signal pathway. Am J Physiol Heart Circ Physiol. 2007;292(3):H1630-3. [MedLine]
12. Pirnia F, Schneider E, Betticher DC, Borner MM. Mitomycin C induces apoptosis and caspase-8 and -9 processing through a caspase-3 and Fas-independent pathway. Cell Death Differ. 2002;9(9):905-14. [MedLine]
13. Lee S, Huang CS, Kawamura T, Shigemura N, Stolz DB, Billiar TR, et al. Superior myocardial preservation with HTK solution over Celsior in rat hearts with prolonged cold ischemia. Surgery. 2010;148(2):463-73. [MedLine]
14. Anselmi A, Abbate A, Girola F, Nasso G, Biondi-Zoccai GG, Possati G, et al. Myocardial ischemia, stunning, inflammation, and apoptosis during cardiac surgery: a review of evidence. Eur J Cardiothorac Surg. 2004;25(3):304-11. [MedLine]
15. Lee Y. To proliferate or not to proliferate. Cardiovasc Res. 2010;86(3):347-8. [MedLine]
16. Walsh S, Pontén A, Fleischmann BK, Jovinge S. Cardiomyocyte cell cycle control and growth estimation in vivo: an analysis based on cardiomyocyte nuclei. Cardiovasc Res. 2010;86(3):365-73. [MedLine]
17. Committee on Care and Use of Laboratory Animals - Institute of Laboratory Animal Resources - Commission on Life Sciences - National Research Council. Guide for the care and use of laboratory animals. 8th ed. Washington: National Academies Press; 2010. 211p.
18. Lahaye Sle D, Gratas-Delamarche A, Malardé L, Vincent S, Zguira MS, Morel SL, et al. Intense exercise training induces adaptation in expression and responsiveness of cardiac ß-adrenoceptors in diabetic rats. Cardiovasc Diabetol. 2010;9:72. [MedLine]
19. Kusumi T, Minakawa M, Fukui K, Saito S, Ohashi M, Sato F, et al. Cardiac tumor comprising two components including typical myxoma and atypical hypercellularity suggesting a malignant change. Cardiovasc Pathol. 2009;18(6):369-74. [MedLine]
20. Suvarna SK, Royds JA. The nature of the cardiac myxoma. Int J Cardiol. 1996;57(3):211-6. [MedLine]
21. Brunner-La Rocca HP, Vogt PR, Burke AP, Schneider J, Jenni R, Turina MI. A primary cardiac sarcoma with unusual histology and clinical course. Ann Thorac Surg. 2001;71(5):1675-7. [MedLine]
Não houve suporte financeiro.
Papéis & responsabilidades dos autores
MABO: Desenho do estudo, realização dos experimentos, análise dos resultados e redação do manuscrito
LCF: Auxílio nas técnicas imuno-histoquímicas
DAPCZ: Auxílio nas técnicas imuno-histoquímicas
ACB: Participação na elaboração do texto final
CAS: Participação na elaboração do texto final
PHHB: Participação na elaboração texto final
OP: Revisão versão final
DMB: Desenho do estudo, análise dos resultados e redação do manuscrito
Article receive on quinta-feira, 17 de outubro de 2013
 All scientific articles published at www.rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at www.rbccv.org.br are licensed under a Creative Commons license