Objetivo: Comparar pacientes submetidos à ultrafiltração convencional (UFC), sem e com modificação técnica que permite aproveitamento do sangue residual do circuito de tubos e do oxigenador.
Método: No período de março de 2002 a janeiro de 2005, 301 pacientes submetidos à correção de cardiopatias congênitas com circulação extracorpórea (CEC) foram analisados, retrospectivamente, e divididos em dois grupos: A - constituído de 130 pacientes submetidos à UFC clássica e grupo B - constituído de 171 pacientes submetidos à UFC com modificação técnica para aproveitamento do sangue residual. Foram comparadas variáveis demográficas, diagnóstico, tratamento cirúrgico, dados do período intra-operatório e pós-operatório, necessidade e volume de transfusões, exames laboratoriais e permanência hospitalar.
Resultados: Não houve diferença no valor inicial de hematócrito antes da CEC (p = 0,06), mas no grupo B, os valores após a ultrafiltração foram maiores (p < 0,0001). O grupo B foi mais transfundido nas primeiras 48 horas do pós-operatório (p < 0,0001). Não houve diferença no tempo de ventilação mecânica (p = 0,34), mas o tempo de uso de drogas vasoativas (p < 0,0001), tempo de uso de antibióticos (p = 0,0006), tempo de internação na unidade de terapia intensiva (p < 0,0001) e o tempo total de internação no pós-operatório (p < 0,0001) foram maiores no grupo B.
Conclusões: A UFC com a modificação técnica não apresentou resultados superiores aos da UFC clássica, pois, apesar de elevar o hematócrito após a circulação extracorpórea, proporcionou maior sangramento no pós-operatório com maior necessidade de transfusão de hemoderivados e prolongamento do tempo de permanência hospitalar.
Objective: To compare patients submitted to the conventional ultrafiltration (CUF) with and without a technical modification that allows use of residual blood from the circuit tubes and oxygenator.
Method: From March 2002 to January 2005, 301 patients undergoing to congenital heart defects surgery with cardiopulmonary bypass (CPB) were retrospectively analyzed and divided in two groups: Group A - 130 submitted to CUF and Group B, 171 patients submitted to CUF with a technical modification that uses residual blood. Demographic data, diagnosis, surgical treatment, intra-operative and postoperative data, the need and amount of blood transfusions, laboratorial results and length of hospital stay were compared between the groups.
Results: There was no differences in the initial hematocrit before CPB (p = 0.06), but in the Group B, the values after ultrafiltration were higher (p <0.0001). Group B patients received more transfusions in the first 48 hours of the postoperative period (p <0.0001). There was no signicant difference in the time of mechanical ventilation (p = 0.34), but the inotropic support (p <0.0001), antibiotic therapy (p = 0.0006), length of stay in the intensive care unit (p <0.0001) and length of hospital stay (p <0.0001) were greater for Group B.
Conclusions: CUF with the technical modification was not better than conventional CUF, because in spite of elevating the hematocrit after the CBP, it caused greater postoperative bleeding with a greater need of blood transfusions and longer hospitalar stays.
INTRODUÇÃO
A ultrafiltração (UF) é um procedimento rotineiro realizado nas operações cardíacas com circulação extracorpórea (CEC) com o intuito de remover mediadores inflamatórios [1-5], diminuir a sobrecarga de volume [1,3] e a necessidade de transfusão de hemoderivados [1,6,7]. A resposta inflamatória sistêmica que ocorre em neonatos e crianças após CEC resulta no aumento da permeabilidade capilar, levando a uma maior morbidade e mortalidade [8]. Esse processo pode levar à sobrecarga de volume, dificultando as trocas gasosas e retardando a retirada progressiva da ventilação mecânica. Além disso, a hemodiluição plaquetária e de fatores de coagulação relacionados à CEC pioram a hemostasia, sendo normalmente observada nas crianças [9].
A UF realizada durante a CEC é chamada de UF convencional (UFC). Neste modelo, a UF do perfusato é realizada enquanto o paciente se encontra assistido pela máquina coração-pulmão, e o hemoconcentrador é acoplado na linha de recirculação entre o oxigenador e o reservatório venoso [1]. Em nosso meio, a UFC tem sido utilizada com uma modificação técnica que permite o aproveitamento do sangue residual do circuito de tubos e oxigenador após a CEC, sem interferir no comportamento hemodinâmico do paciente [10].
Assim, propomos comparar pacientes submetidos exclusivamente à UFC, sem e com esta modificação técnica, analisando dados laboratoriais, necessidade de transfusão de hemoderivados e evolução clínica no pós-operatório imediato.
MÉTODO
No período de março de 2002 a janeiro de 2005, 301 pacientes submetidos à correção de cardiopatias congênitas, exclusivamente com UFC, foram analisados, retrospectivamente, e divididos em dois grupos: grupo A - constituído de 130 pacientes submetidos à UFC clássica (operados no período de março de 2002 a março de 2003); e grupo B - constituído de 171 pacientes submetidos à UFC com modificação técnica de aproveitamento do sangue residual do circuito de tubos e oxigenador (operados no período de abril de 2003 a janeiro de 2005).
Descrição da circulação extracorpórea
O circuito para a CEC foi composto por oxigenadores de membrana, com tubos de cloreto de polivinila (PVC), reservatório de cardiotomia, filtro de linha arterial com capacidade de filtração de partículas maiores que 40 micrômetros (m), sistema de cardioplegia sangüínea e hemoconcentradores de fibra de acetato de celulose (*). Os oxigenadores foram utilizados de acordo com o peso dos pacientes: oxigenador neonatal - até 8 kg com tubos de 3/16\''; oxigenador infantil - de 8 a 22 kg com tubos de 1/4\''; oxigenador pediátrico - de 22 a 50 kg com tubo arterial de 3/8\'' e duas cavas de 3/8\''; e oxigenador adulto - acima de 50 kg com tubo arterial de 3/8\'' e duas cavas de 3/8\''.
A bomba utilizada na CEC foi a BEC 2000, composta de um módulo arterial e 3 módulos aspiradores, e a bomba de cardioplegia, composta de um módulo propulsor e um trocador de calor (*).
Antes da composição do perfusato, todos os circuitos foram previamente lavados com solução de Ringer Lactato, variando de 800 mL para o neonatal a 2000 mL para o adulto. Na composição do perfusato, a hemodiluição total ou parcial foi baseada na seguinte fórmula:
[(P x 0,08 + VP) x Htd) - (P x 0,08 x Htp)] / MACG
onde:
P - peso;
0,08 - constante para volemia;
VP - volume do perfusato;
Htd - hematócrito desejado em CEC;
Htp - hematócrito do paciente antes da CEC;
MACG - Média aritmética do Ht nas bolsas de concentrado globular.
A heparinização total foi obtida utilizando-se heparina não fracionada na dose de 400 UI/kg de peso, administrada diretamente no átrio direito pelo cirurgião.
Os fluxos de perfusão variaram segundo a escala:
< 5 kg - 150 a 200 mL/kg/min;
6 a 10 kg - 100 a 150 mL/kg/min;
11 a 20 kg - 80 a 100 mL/kg/min;
21 a 40 kg - 60 a 80 mL/kg/min;
40 kg - 40 a 60 mL/kg/min.
A proteção miocárdica fez-se com cardioplegia sangüínea gelada e solução cardioplégica de St. Thomas, sendo infundida a 30 mL/kg após o pinçamento aórtico para indução e repetida na dose de 20 a 30 mL/kg a cada 15 minutos.
A UF foi iniciada no período de aquecimento com pressão transmembrana de 150 a 250 mmHg, filtrando-se 10 a 15 mL/min. A pressão transmembrana foi aumentada para 350 a 450 mmHg no final da CEC e na UF do sangue residual, filtrando-se de 40 a 75 mL/min.
Após a saída de CEC, neutralizou-se a heparina não fracionada com protamina na dose de 1,0 a 1,5 mg de protamina para 100 UI de heparina.
Descrição das técnicas de ultrafiltração
No grupo A (UFC clássica), o hemoconcentrador foi acoplado à linha de recirculação, a qual conecta o oxigenador ao reservatório venoso. Após início do aquecimento, a linha do hemoconcentrador (recirculação) foi despinçada e, posteriormente, pinçada parcialmente, com o intuito de limitar a quantidade de sangue que passava pelo hemoconcentrador. Este tipo de hemoconcentração terminou com a retirada da cânula arterial e todo o sangue remanescente do circuito da CEC foi desprezado (Figura 1).
No grupo B (UFC com modificação técnica), o aproveitamento do sangue residual foi constituído pelo sistema de cardioplegia, conectado em paralelo com um tubo de 1/8 e dois "Y" de 1/8 x 1/8 x 1/8 na saída da bomba de cardioplegia e entrada do hemoconcentrador. Após a saída de CEC, ocorreu a coleta do volume contido nos tubos das cavas, sendo colocado no reservatório venoso 500 ml de solução de Ringer lactato para deslocar o volume residual do circuito em direção ao reservatório de cardioplegia, por meio de derivação do filtro de linha arterial. Este volume foi ultrafiltrado novamente, retirando-se 40 a 50% de água e o concentrado infundido ao paciente por veia periférica (Figuras 2A, 2B e 2C).
Foram comparados variáveis relacionadas a dados demográficos, diagnóstico da cardiopatia, tratamento cirúrgico realizado, dados dos períodos intra e pós-operatório, necessidade e volume de transfusões, exames laboratoriais (hematócrito, tempo e atividade de protrombina, tempo de tromboplastina ativado, INR - International Normalized Ratio, plaquetas e creatinina) e tempo de permanência hospitalar.
As doenças foram agrupadas e classificadas da seguinte maneira:
· comunicação interatrial (CIA), incluiu-se CIA e CIA associada à persistência do ducto arterial (PDA);
· comunicação interventricular (CIV) considerou-se CIV, CIV com PDA e CIV com CIA;
· doenças de fisiologia univentricular com ventrículo principal tipo direito e esquerdo, defeitos do canal atrioventricular nas formas parcial (DCAVP) e total (DCAVT), tetralogia de Fallot (T4F), transposição das grandes artérias (TGA);
· outros diagnósticos - valvopatias, janela aortopulmonar, artéria coronária anômala, síndrome de Shone e túnel ventrículo esquerdo-aorta.
Os procedimentos cirúrgicos realizados foram: atriosseptoplastia, realizada por fechamento com sutura direta ou uso de placa de pericárdio bovino, associada ou não à ligadura do ducto arterial. Na ventriculosseptoplastia, fez-se fechamento com sutura direta ou, mais comumente, com utilização de placa de pericárdio bovino, associada ou não à ligadura do ducto arterial ou fechamento da CIA quando presentes. No DCAVP, a fenda da valva atrioventricular esquerda foi fechada e a CIA tipo ostium primum, corrigida com placa de pericárdio bovino. Na correção do DCAVT, utilizou-se a técnica da placa dupla (double patch) em todos os pacientes. Na T4F, a CIV foi fechada com placa de pericárdio bovino e a ampliação da via de saída do ventrículo direito, valva e tronco pulmonar ocorreram conforme necessidade. As operações de Jatene e de Senning foram as opções para o tratamento da TGA. A operação de Glenn (cavopulmonar superior bidirecional) foi associada ou não à ligadura do tronco pulmonar, atriosseptectomia ou ampliação dos ramos pulmonares, de acordo com a necessidade. Doenças menos comuns, incluídas como outros diagnósticos, foram corrigidas com os procedimentos cirúrgicos classicamente padronizados.
Os diagnósticos pré-operatórios (alguns associados), assim como os procedimentos cirúrgicos realizados, estão descritos nas Tabelas 1 e 2.
Os dados do período intra-operatório foram obtidos da ficha de perfusão, a qual forneceu peso, altura, superfície corpórea, hematócrito inicial e ao final da CEC, transfusão de concentrado globular pré-CEC adicionado ao perfusato, tempo de perfusão e isquemia, temperatura mínima, volume inicial do perfusato, volemia total do paciente, volume total de UF e balanço hídrico ao final da CEC.
Pelo prontuário eletrônico obteve-se a identificação do paciente (nome e número de registro), data de nascimento, sexo, diagnóstico pré-operatório, operação realizada, coagulograma e creatinina pré e pós-operatórios. O débito sangüíneo pelos drenos, volume de transfusão de hemoderivados, diurese e necessidade de diálise foram acompanhados nas primeiras 48 horas após intervenção cirúrgica. O tempo de antibioticoterapia, o uso de drogas vasoativas (inotrópicos, anti-hipertensivos e antiarrítmicos endovenosos), tempo de internação em unidade de terapia intensiva e hospitalar também foram verificados.
A análise estatística permitiu apresentar os dados categóricos em números absolutos e porcentuais, sendo as variáveis contínuas apresentadas como mediana (valor mínimo e máximo), quando aplicável. Nas comparações univariadas entre variáveis categóricas foi utilizado o teste exato de Fisher e para variáveis contínuas, o teste não paramétrico de Mann-Whitney. Análises de regressão simples linear foram realizadas quando aplicáveis. Todos os valores de p são bicaudais e valores menores que 0,05 considerados estatisticamente significativos. Os programas auxiliares foram o GraphPad Instat v. 3.00 e Stats Direct Statistics Software v. 1.617.
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de São José do Rio Preto, protocolo número 3919/2005.
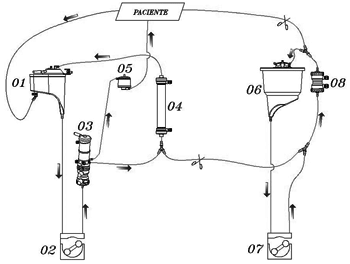
Fig. 1 - Desenho esquemático da ultrafiltração convencional (UFC) com uso do luer do oxigenador retornando sangue ao reservatório venoso. 01- reservatório venoso, 02- bomba arterial, 03- oxigenador, 04- hemoconcentrador, 05- filtro arterial, 06- reservatório de cardioplegia, 07- bomba de cardioplegia, 08- trocador de calor

Fig. 2A - Transporte do volume residual do circuito para o reservatório de cardioplegia, direcionando o sangue com 500 ml de solução de Ringer-lactato pela derivação do filtro arterial. 01- reservatório venoso, 02- bomba arterial, 03- oxigenador, 04- hemoconcentrador, 05- filtro arterial, 06- reservatório de cardioplegia, 07- bomba de cardioplegia, 08- trocador de calor
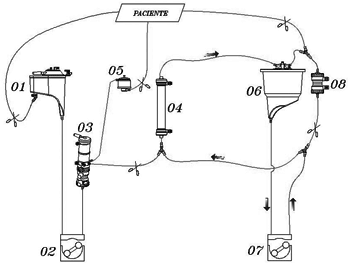
Fig. 2B - Ultrafiltração do volume residual do oxigenador transportado para o reservatório de cardioplegia. 01- reservatório venoso, 02- bomba arterial, 03- oxigenador, 04- hemoconcentrador, 05- filtro arterial, 06- reservatório de cardioplegia, 07- bomba de cardioplegia, 08- trocador de calor
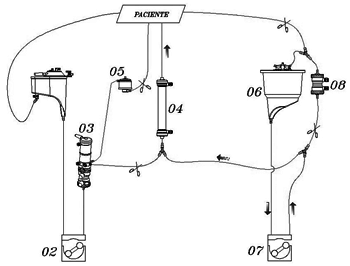
Fig. 2C - Infusão do sangue concentrado para o paciente em veia periférica. 01- reservatório venoso, 02- bomba arterial, 03- oxigenador, 04- hemoconcentrador, 05- filtro arterial, 06- reservatório de cardioplegia, 07- bomba de cardioplegia, 08- trocador de calor
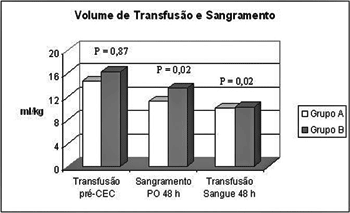
Fig.3 - Comparação entre os grupos A e B com relação à necessidade de transfusão de concentrado de hemácias antes da circulação extracorpórea (CEC), sangramento no pós-operatório (PO) e necessidade de transfusão após o procedimento cirúrgico
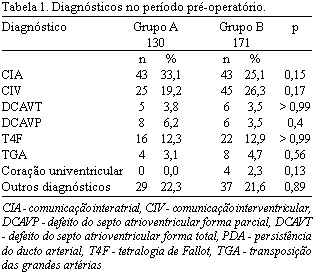
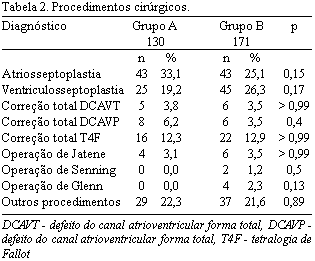
Dos 301 pacientes, 136 (45,2%) eram do sexo masculino e a mediana de idade foi de 3 anos e 9 meses, variando de 1 dia a 49 anos e 2 meses. Na comparação entre os grupos, não houve diferenças estatisticamente significantes quanto a sexo (p = 0,55), idade (1460 dias vs. 1175 dias; p = 0,45), peso (15,2 kg vs. 12,6 kg; p = 0,30), superfície corporal (0,64 m2 vs. 0,55 m2; p = 0,25) e tempo de internação pré-operatório (1 dia vs. 1 dia; p = 0,89).
O valor inicial de hematócrito foi de 35% vs. 36% (p = 0,06) e os valores após a UF foram 26% vs. 34% (p < 0,0001). O INR do grupo A foi maior, tanto antes da CEC (1,1 vs. 1,0; p < 0,0001), quanto após a UF (1,5 vs. 1,4; p < 0,0001). A contagem de plaquetas antes da CEC foi de 295 mil/mm3 vs. 287 mil/mm3 (p = 0,18) e após UF foi de 168 mil/mm3 vs. 153 mil/mm3 (p = 0,10).
As variáveis analisadas durante o ato operatório foram equivalentes entre os grupos quanto ao tempo de perfusão (80 min vs. 75 min; p = 0,27), tempo de isquemia (57,5 min vs. 56 min; p = 0,23), temperatura mínima de CEC (28º C vs. 27,6º C; p = 0,79), volume inicial do perfusato (102,8 ml/kg vs. 103,4 ml/kg; p = 0,87), volemia do paciente (80 ml/kg vs. 80 ml/kg; p = 0,62), balanço hídrico final (- 1,8 ml/kg vs. 2,3 ml/kg; p = 0,09) e volume total de UF (45,6 ml/kg vs. 50,4 ml/kg; p = 0,06).
Com relação ao uso de hemoderivados, houve uma maior proporção de pacientes transfundidos nas primeiras 48 horas no grupo B (66,2% vs. 86,5 %; p < 0,0001), com maior volume infundido (10,0 ml/kg vs. 10,2 ml/kg; p = 0,02). A transfusão de plasma fresco também foi maior no grupo B (62,3% vs 83,6%; p < 0,0001), com volume infundido também maior (9,8 ml/kg vs. 13,9 ml/kg; p = 0,0006) e o número de pacientes transfundidos com crioconcentrado também foi maior neste grupo (10,8% vs. 27,5%; p = 0,0004), como observado na Figura 3.
Os pacientes do grupo B tiveram valor de creatinina maior no pré-operatório (0,5 mg/dL vs. 0,5 mg/dL - IC 95% - 0,1 a 0; p = 0,0018), mas, no segundo dia após a operação, a creatinina foi maior no grupo A (0,6 vs. 0,5 - IC 95% - 0,2 a - 0,1; p < 0,0001). O volume de diurese nas primeiras 48 horas após a operação foi de 3,3 ml/kg/h vs. 4,8 ml/kg/h (p < 0,0001). O tempo de ventilação mecânica foi de 8 vs. 8 horas (p = 0,34), e o tempo de uso de drogas vasoativas de 2 dias vs. 3 dias (p < 0,0001). O tempo de uso de antibióticos (2 dias vs. 2 dias - IC 95% 0 a 0; p = 0,0006), tempo de internação na unidade de terapia intensiva (4 dias vs. 5 dias; p < 0,0001) e o tempo total de internação no pós-operatório (6 dias vs. 8 dias; p < 0,0001) foram maiores no grupo B.
DISCUSSÃO
O emprego da UFC em cirurgia cardíaca com CEC constitui-se num procedimento consagrado, com importante contribuição no manejo do paciente no período intra-operatório, permitindo eliminar o excesso de água corporal e remover agentes inflamatórios como C3a e C5a [2,3,5], TNF-α e IL-6 e 8 [3], principalmente na fase de reaquecimento. Sabe-se que o aumento do conteúdo de água corporal é mais expressivo em crianças de baixo peso submetidas a CEC prolongada em baixas temperaturas. Devido aos efeitos da hemodiluição serem mais evidentes em crianças, causados pela desproporção do volume do perfusato no circuito de CEC, o benefício potencial da UFC pode ser mais significativo nestes pacientes. Tal conhecimento justificou estudo comparativo de pacientes com cardiopatias congênitas submetidos a tratamento cirúrgico com CEC, onde a maioria deles eram crianças com mediana de idade de 39,2 meses, semelhante a estudos anteriores, os quais comparam técnicas de UF, denotando o interesse global no estudo dos efeitos benéficos da UFC em pacientes com peso reduzido [11,12].
A complexidade cirúrgica alavancada pelo diagnóstico pré-operatório deve ser considerada como fator importante na evolução destes pacientes [13]. Hipertensão pulmonar, cianose e desnutrição representam maiores riscos cirúrgicos e de complicações pós-operatórias. Cardiopatias congênitas com hipertensão pulmonar moderada a grave, onde a relação entre a pressão pulmonar e sistêmica é maior ou igual a 60%, aumentam a permanência em unidade de terapia intensiva e a necessidade de ventilação mecânica. A intervenção cirúrgica em crianças com cardiopatias congênitas complexas requer maior tempo de CEC e baixas temperaturas, maior tempo de perfusão e de isquemia, aumentando o risco de retenção hídrica [1]. Nos dois grupos avaliados neste estudo, os tempos de perfusão e isquemia foram semelhantes, mostrando homogeneidade na distribuição dos pacientes quanto à complexidade das cardiopatias.
Sabendo-se que a hipotermia aumenta a viscosidade sangüínea, a hemodiluição torna-se necessária para melhorar o transporte de oxigênio aos tecidos, pois este é inversamente proporcional à viscosidade do sangue. Desta forma, um menor hematócrito é mais apropriado a baixas temperaturas, o que pode ser obtido com a hemodiluição [14]. Considerando-se uma volemia de 80 ml/kg, o volume inicial de perfusato foi semelhante nos dois grupos (102,8 ml/kg vs. 103,4 ml/kg, p = 0,87), lembrando que a relação entre a volemia do paciente e o perfusato em crianças é diferente da dos indivíduos adultos, mantendo-se sempre menores que 1 [1] e havendo interesse no uso de circuitos cada vez menores para aplicação nestes pacientes.
O volume total de fluídos adicionados ao perfusato, volume total do ultrafiltrado e o balanço hídrico final estão proporcionalmente inter-relacionados [14]. Em nosso estudo, a adição de fluidos ao perfusato (concentrado de hemácias, plasma, albumina, manitol e bicarbonato de sódio) seguiu padrões técnicos equivalentes nos grupos A e B, considerando o peso e a superfície corpórea. Isto se refletiu no volume total do ultrafiltrado e balanço hídrico final sem diferença estatística entre os pacientes analisados.
A UFC proporciona estabilização hemodinâmica e ventilatória, redução do edema generalizado e menor necessidade de diálise peritoneal. Assim, o controle de fluídos previamente à operação influencia diretamente o equilíbrio hemodinâmico pós-operatório imediato, refletindo-se na função cardíaca, renal, respiratória e homeostase [14].
A imaturidade renal observada em crianças de baixo peso pode retardar o equilíbrio hídrico, razão pela qual diuréticos e diálise peritoneal são coadjuvantes neste processo [15]. Na nossa casuística, a qual não foi limitada somente a crianças de baixo peso, não houve diferença estatística na indicação de diálise. A creatinina de admissão foi maior no grupo B, enquanto que a creatinina do segundo dia de pós-operatório foi maior no grupo A.
A melhora da oxigenação tissular, especialmente nos pacientes com hipertensão pulmonar, se dá pela remoção do excesso de fluídos e mediadores inflamatórios, com otimização da função pulmonar, diminuição do tempo de ventilação mecânica e de permanência em unidade de terapia intensiva [3]. Sabe-se que a injúria do endotélio pulmonar mediada por neutrófilos e o aumento da permeabilidade vascular pulmonar contribuem para as alterações da função deste órgão [16]. É provável também que a UFC durante a CEC tenha um efeito benéfico na redução do edema e na função miocárdica, assim como na função pulmonar [2]. A resposta inflamatória sistêmica que ocorre em neonatos e crianças após CEC resulta no aumento da permeabilidade capilar, levando a maior morbidade e mortalidade [8]. Esse processo pode levar à sobrecarga de volume, dificultando as trocas gasosas e retardando a retirada progressiva da ventilação mecânica. Nos pacientes avaliados em nosso estudo não houve diferenças no tempo de ventilação mecânica.
Considerando que a hemodiluição é responsável pela diminuição dos fatores de coagulação em até 50% e diminuição da contagem de plaquetas em até 70% após o início da CEC [9], a UFC pode atenuar tais efeitos deletérios ao final do procedimento. A importância da hemoconcentração com o intuito de minimizar o uso de hemoderivados, com maior aproveitamento do sangue remanescente do oxigenador, foi descrita por Souza e Braile[10], trazendo como vantagens a redução da demanda nos bancos de sangue, do risco de doenças (hepatite, SIDA), reação à transfusão e dos distúrbios da coagulação.
A diminuição do hematócrito por sangramento no pós-operatório é deletéria ao organismo, acarretando diminuição da função do ventrículo esquerdo e diminuindo a oferta de oxigênio aos tecidos, podendo prolongar o uso de drogas vasoativas. Além disso, o sangramento pós-operatório gera maior necessidade de transfusões de hemoderivados, estando associado ao maior risco de infecções bacterianas e virais, maior necessidade de antibioticoterapia, prolongamento na internação e mortalidade [17,18].
Em nosso estudo, os pacientes do grupo B tiveram maior sangramento nas primeiras 48 horas após a operação, necessitando maior volume de transfusão de concentrado globular, plasma fresco e crioconcentrado, logo permanecendo mais tempo em uso de drogas vasoativas e necessitando maior tempo de permanência na unidade de terapia intensiva. Apesar de maior hematócrito ao final do procedimento cirúrgico, a utilização de UFC com a modificação técnica de aproveitamento do sangue residual do circuito de tubos e do oxigenador não foi eficaz em reduzir a necessidade de transfusão de hemoderivados, refletindo-se na maior utilização de drogas vasoativas e maior permanência em unidade de terapia intensiva no pós-operatório. Tal fato pode ter várias explicações, entre elas é possível acreditar que o reaproveitamento deste sangue presente no circuito (o qual foi submetido a maior concentração, proporcionando maior destruição dos elementos do sistema de coagulação, quando devolvido ao paciente) ocasionava acréscimo de volume, sem poder de coagulação e com o agravante de conter heparina, a qual neste momento já havia sido totalmente revertida com protamina.
Na análise de regressão simples linear, a utilização da UFC com modificação técnica de aproveitamento do sangue residual de tubos e do oxigenador foi preditor independente para maior tempo de utilização de drogas vasoativas, maior tempo de utilização de antibióticos, maior tempo de internação em unidade de terapia intensiva e permanência hospitalar após a operação, todos como conseqüência do exposto acima.
CONCLUSÕES
No conjunto das variáveis analisadas, a UFC com modificação técnica para aproveitamento do sangue residual do circuito de tubos e do oxigenador apresentou resultados inferiores à UFC clássica, pois, apesar de ser efetiva na elevação do hematócrito após a CEC, proporcionou, neste grupo, maior sangramento no pós-operatório com maior necessidade de transfusão de hemoderivados e prolongamento da permanência hospitalar.
(*) Braile Biomédica Industria, Comércio e Representações S/A
REFERÊNCIAS
1. Maluf MA, Mangia C, Bertuccez J, Silva C, Catani R, Carvalho W et al. Estudo comparativo da ultrafiltração convencional e associação de ultrafiltração convencional e modificada na correção de cardiopatias congênitas com alto risco cirúrgico. Rev Bras Cir Cardiovasc. 1999;14(3):221-36.
2. Pearl JM, Manning PB, McNamara JL, Saucier MM, Thomas DW. Effect of modified ultrafiltration on plasma thromboxane B2, leukotriene B4, and endothelin-1 in infants undergoing cardiopulmonary bypass. Ann Thorac Surg. 1999;68(4):1369-75.
3. Journois D, Pouard P, Greeley WJ, Mauriat P, Vouhe P, Safran D. Hemofiltration during cardiopulmonary bypass in pediatric cardiac surgery. Effects on hemostasis, cytokines, and complement components. Anesthesiology. 1994;81(5):1181-9.
4. Millar AB, Armstrong L, van der Linden J, Moat N, Ekroth R, Westwick J et al. Cytokine production and hemofiltration in children undergoing cardiopulmonary bypass. Ann Thorac Surg. 1993;56(6):1499-502.
5. Andreasson S, Gothberg S, Berggren H, Bengtsson A, Eriksson E, Risberg B. Hemofiltration modifies complement activation after extracorporeal circulation in infants. Ann Thorac Surg. 1993;56(6):1515-7.
6. Elliott MJ. Ultrafiltration and modified ultrafiltration in pediatric open heart operations. Ann Thorac Surg. 1993;56(6):1518-22.
7. Naik SK, Knight A, Elliott M. A prospective randomized study of a modified technique of ultrafiltration during pediatric open-heart surgery. Circulation. 1991;84(5 suppl):III422-31.
8. Kirklin JK, Blackstone EH, Kirklin JW. Cardiopulmonary bypass: studies on its damaging effects. Blood Purif. 1987;5(2-3):168-78.
9. Kern FH, Morana NJ, Sears JJ, Hickey PR. Coagulation defects in neonates during cardiopulmonary bypass. Ann Thorac Surg. 1992;54(3):541-6.
10. Souza DD, Braile DM. Avaliação de nova técnica de hemoconcentração e da necessidade de transfusão de hemoderivados em pacientes submetidos à cirurgia cardíaca com circulação extracorpórea. Rev Bras Cir Cardiovasc. 2004;19(3):287-94.
11. Naik SK, Knight A, Elliott MJ. A successful modification of ultrafiltration for cardiopulmonary bypass in children. Perfusion.1991;6(1):41-50.
12. Journois D, Israel-Biet D, Pouard P, Rolland B, Silvester W, Vouhe P et al. High-volume, zero-balanced hemofiltration to reduce delayed inflammatory response to cardiopulmonary bypass in children. Anesthesiology. 1996;85(5):965-76.
13. Jenkins KJ, Newburger JW, Lock JE, Davis RB, Coffman GA, Iezzoni LI. In-hospital mortality for surgical repair of congenital heart defects: preliminary observations of variation by hospital caseload. Pediatrics. 1995;95(3):323-30.
14. Thompson LD, McElhinney DB, Findlay P, Miller-Hance W, Chen MJ, Minami M et al. A prospective randomized study comparing volume-standardized modified and conventional ultrafiltration in pediatric cardiac surgery. J Thorac Cardiovasc Surg. 2001;122(2):220-8.
15. Draaisma AM, Hazekamp MG, Frank M, Anes N, Schoof PH, Huysmans HA. Modified ultrafiltration after cardiopulmonary bypass in pediatric cardiac surgery. Ann Thorac Surg. 1997;64(2):521-5.
16. Perkowski SZ, Havill AM, Flynn JT, Gee MH. Role of intrapulmonary release of eicosanoids and superoxide anion as mediators of pulmonary dysfunction and endothelial injury in sheep with intermittent complement activation. Circ Res. 1983;53(5):574-83.
17. Murphy PJ, Connery C, Hicks GL Jr, Blumberg N. Homologous blood transfusion as a risk factor for postoperative infection after coronary artery bypass graft operations. J Thorac Cardiovasc Surg. 1992;104(4):1092-9.
18. van de Watering LM, Hermans J, Houbiers JG, van den Broek PJ, Bouter H, Boer F et al. Beneficial effects of leukocyte depletion of transfused blood on postoperative complications in patients undergoing cardiac surgery: a randomized clinical trial. Circulation. 1998;97(6):562-8.







 All scientific articles published at www.rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at www.rbccv.org.br are licensed under a Creative Commons license