A cirurgia do "Labirinto" para tratamento da fibrilação atrial primária, inicialmente proposta por Cox, é relativamente complexa e aumenta o risco de morbidade próprio da cirurgia da valva mitral isoladamente.
OBJETIVO: Apresentar o detalhamento técnico, os conceitos de eletrofisiologia adotados e os resultados iniciais de nova abordagem cirúrgica e eletrofisiológica, incluindo o bloqueio de macrocircuitos atriais específicos definidos por Frame, e otimizando a tática cirúrgica de tratamento da fibrilação atrial.
MÉTODO: Foram operados oito pacientes portadores de fibrilação atrial crônica e disfunção de valva mitral, associada à disfunção de valva tricúspide em um paciente, empregando-se as seguintes modificações principais da cirurgia de Cox: 1- Exclusão da aurícula esquerda por sutura interna, na junção com o átrio esquerdo; 2- Exclusão de aurícula direita por sutura em bolsa de fixação da cânula de drenagem venosa para a veia cava superior; 3- Incisão biatrial única; 4- Eletrocauterização transendocárdica no tecido atrial esquerdo circunjacente aos óstios das veias pulmonares; 5- Substituição das incisões e suturas no átrio esquerdo por eletrocauterização transendocárdica.
RESULTADOS: O tempo de circulação extracorpórea variou de 64 a 133 min (média de 107,5 min) e o tempo de cardioplegia de 40 a 105 min (média de 76,7 min). Ao final da cirurgia, todos os pacientes estavam em ritmo atrial regular. O pós-operatório transcorreu sem complicações cirúrgicas e todos os pacientes receberam alta hospitalar em ritmo atrial regular. Em nenhum paciente foi necessário o implante de marcapasso definitivo. No seguimento ambulatorial, seis meses após a cirurgia, seis (75%) pacientes mantiveram o ritmo atrial com as contrações atriais regulares, e dois apresentaram fibrilação atrial, clinicamente controlada (NYHA II). Também não ocorreram complicações embólicas nem evidência de trombose no controle ecocardiográfico.
CONCLUSÃO: Pode-se concluir, como experiência inicial, que a abordagem eletrofisiológica e a técnica empregada otimizaram o tratamento cirúrgico da fibrilação atrial, possibilitando a correção de lesões valvares mitrais e tricúspide sem morbidade adicional.
INTRODUCTION: The maze procedure for primary atrial fibrillation treatment, initially proposed by Cox, is somewhat complex and increases the morbidity risk originating from the isolated mitral valve surgery itself.
OBJECTIVE: To describe the surgical technique, the concepts of electrophysiology considered and the initial results of a new surgical and electrophysiological approach. Also the blocking of main atrial circuits as defined by Frame and optimization of the surgical tactic for atrial fibrillation treatment are considered.
METHOD: Eight patients with chronic atrial fibrillation and mitral valve dysfunction and with tricuspid valve regurgitation in one case were operated on. The following modifications of the classic Cox procedure were employed: 1. - Exclusion of the left atrium appendage by internal suturing to close its left atrial ostium; 2. - Exclusion of the right atrium appendage by one purse string suture used for the fixation of the superior vena cava draining cannula; 3. - Single atrial incision; 4. - Transendocardial electrocauterization of the left atrium wall around all the pulmonary vein ostia; 5. - Substitution of the incisions and sutures in the left atrium by transendocardial electrocauterization.
RESULTS: The cardiopulmonary bypass time varied from 64 to 133 min (mean 107.5 min) and the cardioplegia time was from 40 to 105 min. (mean 76.7 min). At the end of the surgery all patients were in regular atrial rhythm. The postoperative period was uneventful with all patients discharged from hospital showing regular atrial rhythm, without definitive pacemaker implantation. Six months after surgery, six patients were in regular atrial rhythm (75%) with preserved atrial contractions, and two (25%) with atrial fibrillation, clinically controlled (NYHA II). There was no evidence of embolic complications or thrombosis seen by Doppler echocardiography.
CONCLUSION: It is concluded that in this initial series of cases, the electrophysiolgical approach and the surgical technique employed improved the surgical treatment of atrial fibrillation enabling the correction of mitral and tricuspid valve lesions without additional morbidity.
INTRODUÇÃO
COX [1], em 1991, propôs técnica para tratamento cirúrgico da fibrilação atrial primária, fundamentada em múltiplas incisões e suturas nos átrios direito e esquerdo, demonstrando resultados satisfatórios na recuperação do sincronismo atrial.
JATENE et al. [2], em 1992, confirmaram os benefícios da técnica do "labirinto" também em portadores de doenças valvares reumáticas e GREGORI JR. et al. [3], em 1993, reduziram parte da complexidade dessa operação demonstrando sua exeqüibilidade sem necessidade da crioablação.
Procurando otimizar a reprodutibilidade da operação de Cox e diminuir seu risco relacionado com as múltiplas incisões atriais e com as aderências aumentadas nas reoperações, alternativas cirúrgicas foram propostas por JAZBIK et al. [4], BENUSSI et al. [5], KOTTKAMP et al. [6] e KALIL et al. [7], limitando o tratamento ao átrio esquerdo, como nas propostas originais de COUMEL et al. [8] e WILLIAMS et al. [9].
Contudo, também está demonstrada a existência de focos arritmogênicos localizados na aurícula direita, na porção superior do septo interatrial e na parede livre atrial direita [10,11] (Figura 1).
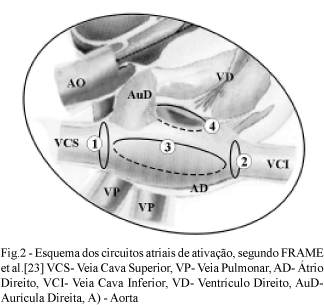
Contribuição especial trazem os estudos de FRAME et al. [12], em 1987, definindo acuradamente a anatomia eletrofisiológica de quatro circuitos principais de reentrada no átrio direito, quais sejam: dois paraostiais, ao nível das desembocaduras das veias cavas superior e inferior no átrio direito, um médio-atrial, circundando a porção média da parede livre dos átrios e septo interatrial, e um circuito paratricuspídeo, próximo da junção do átrio direito com o anel valvar tricuspídeo (Figura 2).
O presente estudo descreve os resultados iniciais obtidos com abordagem biatrial otimizada, em pacientes portadores de doenças valvares reumáticas, fundamentada em conceitos eletrofisiológicos não considerados até o momento, nos procedimentos cirúrgicos descritos para tratamento da fibrilação atrial crônica.
MÉTODO
Com projeto de estudo aprovado pelo Conselho de Ética da Fundação Cardiovascular São Francisco de Assis/ServCor, foram estudados oito pacientes sintomáticos (NYHA II/III), portadores de disfunção valvar mitral de etiologia reumática e insuficiência valvar tricúspide sintomática em um caso, evoluindo com fibrilação atrial crônica há mais de um ano, submetidos à anestesia geral, esternotomia longitudinal e tratamento cirúrgico das disfunções valvares e da fibrilação atrial.
Seis (75%) pacientes eram do sexo feminino, com idades variando entre 21 e 67 anos de idade (média de 35,1 anos) - Tabela 1.
Empregou-se circulação extracorpórea hipotérmica (30-32ºC), com drenagem venosa total por meio de cânulas introduzidas nas veias cavas superior e inferior, através de áreas delimitadas por suturas em bolsas no átrio direito, sendo a sutura destinada ao tubo da veia cava superior posicionada cerca de 5 mm afastada da base da aurícula direita (Figura 1).
A cânula de perfusão arterial sistêmica foi introduzida na porção distal da aorta ascendente e a cânula de perfusão arterial cardioplégica introduzida na sua porção proximal.
A proteção miocárdica foi obtida com perfusão coronária sanguínea hipercalêmica (25 mEq/l), hipotérmica (30-32ºC), pressão de perfusão entre 60-90 mmHg, contínua, com circuito independente da perfusão arterial sistêmica (Modelo Comex Ind. Com. Ltda. BH - MG).
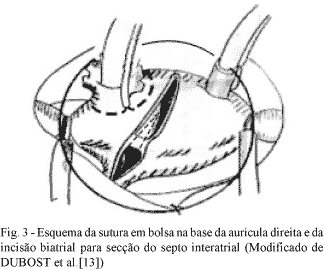
Para exposição da valva mitral e óstios atriais das veias pulmonares e aurícula esquerda, bem como secção de zonas de condução interatriais septais e atrial direita, empregou-se incisão única oblíqua, proposta por DUBOST et al.[13], iniciada cinco milímetros acima do sulco atrioventricular direito e estendida 15 mm no contorno anterior da veia pulmonar superior direita, com secção do septo interatrial, até dez milímetros acima do anel da valva tricúspide (Figura 3).
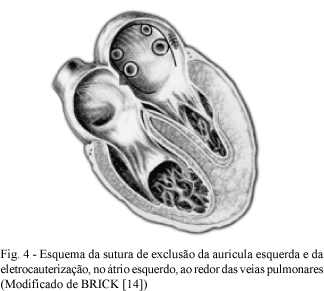
A compartimentalização do átrio esquerdo foi realizada por meio de sutura contínua em chuleio com fio de polipropileno 3-0 nos dois primeiros casos e com uso de bisturi elétrico nos demais, procurando-se isolar os óstios das veias pulmonares e da aurícula esquerda, conforme sistematização empregada por WILLIAMS et al. [9] e modificada por BRICK [14], em nosso meio (Figura 4).
A eletrocauterização foi realizada com intensidade suficiente para ultrapassar o endocárdio, expondo a musculatura atrial subjacente, evitando-se a perfuração da câmara. Outra preocupação foi a cauterização no átrio, deixando margem mínima de 5mm ao redor dos óstios das veias pulmonares.
A aurícula esquerda foi excluída por sutura contínua de sua base, no óstio de comunicação com o átrio esquerdo.
No paciente com insuficiência tricúspide associada foi realizada[15] anuloplastia tipo De Vega, com plicatura de 1/4 do contorno do anel da tricúspide, (na projeção de 12 e 15 horas).
Na reconstrução do septo interatrial, da veia pulmonar superior direita e da parede atrial direita foram utilizadas suturas contínuas, em único plano, com fio de polipropileno 3-0.
A aurícula direita foi excluída pelo fechamento simples de sutura em bolsa própria, após remoção da cânula da veia cava superior.
RESULTADOS
Em todos os pacientes, obteve-se ritmo cardíaco atrial regular, com estabilização hemodinâmica ao final da circulação extracorpórea.
O tempo de perfusão variou de 64 a 133 min, com média de 107,5 min, e o tempo de pinçamento aórtico de 40 a 105 min, com média de 76,7 min. Todos os pacientes receberam alta do CTI com ritmo cardíaco atrial regular mantido.
Durante a internação hospitalar, dois pacientes apresentaram fibrilação atrial, revertida com uso de digital e amiodarona.
Todos os pacientes receberam alta em condições clínicas estáveis, em ritmo regular com presença da onda P, de morfologia variada. Nenhum paciente necessitou de implante de marcapasso permanente. No seguimento pós-operatório de seis meses, dois pacientes retornaram ao ritmo de fibrilação atrial, persistindo nos demais (75%) o ritmo atrial regular, com preservação de contração atrial e ausência de trombose no controle ecocardiográfico.
COMENTÁRIOS
As bases históricas do moderno tratamento cirúrgico da fibrilação atrial tiveram início com a demonstração da presença de musculatura estriada atrial esquerda estendendo-se nas veias pulmonares, feita, em 1836, por RAUSCHEL [16] e, em 1869, por ELISCHER [17] e com os conceitos eletrofisiológicos postulados por ROTHBERGER e WINTERBERG [18], em 1914, considerando que mesmo foco ectópico único poderia determinar a fibrilação atrial total.
LEWIS [19] e LEWIS et al. [20], em 1920, postularam a importância do movimento circular nos circuitos de reentrada, e GARREY [21], em 1924, estudou a segmentação atrial para bloquear a propagação de estímulos anormais e impedir a fibrilação atrial total, conceito adotado na abordagem cirúrgica da operação de Cox.
Coube, entretanto, a COUMEL et al. [8], em 1973, realizarem a primeira cirurgia para tratamento de foco ectópico de arritmia localizado no átrio esquerdo, motivando o subseqüente desenvolvimento das técnicas de isolamento atrial esquerdo, para tratamento de fibrilação atrial.
No átrio direito e septo interatrial alguns estudos demonstraram a possibilidade de tratamento de taquiarritmias pela ablação de focos arritmogênicos localizados nas paredes da aurícula direita, na porção alta do septo interatrial e/ou na parede atrial livre [10,11,22] e os estudos de FRAME et al. [12,23] definiram os circuitos principais responsáveis por taquiarritmias sustentadas.
Considerando-se essa anatomia cirúrgica da arritmogênese no átrio direito, e tendo em vista que a exposição cirúrgica ampla facilita a septação do átrio esquerdo, conceituou-se que a incisão biatrial, proposta por DUBOST et al. [13] para cirurgia da valva mitral, facilitaria também a eletroablação e eletroseptação no átrio esquerdo, ao mesmo tempo em que bloquearia circuitos arritmogênicos na parede livre do átrio direito e na porção septal superior.
A complexidade relativa e o aumento potencial de morbidade da cirurgia do labirinto [24-26] têm motivado o procedimento restrito apenas ao átrio esquerdo e sua realização com bisturi de ultra-som [27], ou por aplicação de radiofreqüência [28], reduzindo a secção e sutura nas paredes atriais, mantendo-se, contudo, o sucesso da conversão para ritmo atrial regular, em 70-80% dos pacientes.
No presente estudo, optou-se pelo tratamento com uso do bisturi elétrico simples (Eletrocautério ou bisturi diatérmico), como defendido por BATH [29], e também com base em resultados satisfatórios obtidos por BRICK entre nós (comunicação pessoal). Cuidado especial foi dado a eletrocauterização atrial, respeitando-se margem mínima de cinco milímetros ao redor dos óstios das veias pulmonares para prevenir a estenose [30].
A sistematização técnica empregada na presente investigação otimizou a cirurgia da fibrilação atrial, substituindo a ressecção das aurículas direita e esquerda pela sutura em bolsa de introdução da cânula da veia cava superior no átrio direito, e pela sutura de fechamento do colo da aurícula esquerda, por via intra-atrial esquerda, respectivamente, bem como facilitou a exposição interna ampla do átrio esquerdo pela técnica de DUBOST et al. [13], reduzindo a extensão das suturas no átrio direito. Do ponto de vista eletrofisiológico, a incisão única no átrio direito excluiu um dos circuitos de reentrada de estímulos na parede atrial e também vias septais. Como os circuitos próximos dos óstios das veias cavas superior e inferior foram admitidos por FRAME et al. [12] como incapazes de geração de taquiarritmias, sua ablação pode ser realizada facilmente por aplicação de radiofreqüência ou diatermia epimiocárdica, em casos com fibrilação atrial persistente ao final da operação. A última opção, em casos refratários, pode ser, ainda, a interrupção do circuito paratricuspídeo de FRAME et al. [12], que pode ser bloqueado por eletrocauterização intracardíaca, e secção do septo interatrial até o anel tricúspide ou, externamente, prolongando-se a atriotomia na parede livre do átrio direito até o sulco atrioventricular, com o cuidado para não lesar a artéria coronária direita. O bloqueio deste circuito, entretanto, poderá dificultar a função do nó atrioventricular e propiciar a exigência do implante de marcapasso definitivo.
Em estudos recentes, CHIAPPINI et al. [31] e COX [32] comprovam a conveniência e vantagem de procedimentos com menor morbidade e menor complexidade cirúrgica, no contexto geral do tratamento da fibrilação atrial, o que põe em maior destaque o potencial de benefícios da abordagem definida neste estudo.
Em análise geral deste estudo inicial, pode-se concluir que a técnica empregada e os fundamentos eletrofisiológicos considerados simplificaram a cirurgia, praticamente reduzida à incisão atrial única, e racionalizaram o escalonamento do bloqueio dos circuitos potencialmente arritmogênicos, possibilitando o tratamento da fibrilação atrial e a correção das lesões valvares mitrais e tricúspides sem morbidade adicional. Os mesmos critérios de bloqueio eletrofisiológico facilitam a racionalização do tratamento endovascular da fibrilação atrial, quando não seja necessária intervenção direta nas valvas mitral e tricúspide.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Cox JL. The surgical treatment of atrial fibrillation. IV. Surgical technique. J Thorac Cardiovasc Surg 1991;101:584-92.
[ Medline ]
2. Jatene AD, Sosa E, Tarasoutchi F, Jatene MB, Pomerantzeff PMA. Tratamento cirúrgico da fibrilação atrial. Procedimento do "labirinto": experiência inicial. Rev Bras Cir Cardiovasc 1992;7:107-11.
[ Lilacs ]
3. Gregori Jr F, Cordeiro C, Goulart M, Couto N, Rosa V, Silva SS et al. Técnica de Cox sem crioablação para tratamento cirúrgico da fibrilação atrial. Rev Bras Cir Cardiovasc 1993;8:220-4.
[ Lilacs ]
4. Jazbik JC, Coutinho JH, Amar MR. Tratamento cirúrgico da fibrilação atrial em pacientes com insuficiência mitral: proposta inicial de uma nova abordagem cirúrgica. Rev SOCERJ1993;6:142-5.
5. Benussi S, Pappone C, Nascimbene S, Oreto G, Caldarola A, Stefano PL et al. A simple way to treat chronic atrial fibrillation during mitral valve surgery: the epicardial radiofrequency approach. Eur J Cardiothorac Surg 2000;17:524-9.
[ Medline ]
6. Kottkamp H, Hindricks G, Hammel D, Autschbach R, Mergenthaler J, Borggrefe M et al. Intraoperative radiofrequency ablation of chronic atrial fibrillation: a left atrial curative approach by elimination of anatomic "anchor" reentrant circuits. J Cardiovasc Electrophysiol 1999;10:772-80.
[ Medline ]
7. Kalil RAK, Lima GG, Abrahão R, Sturmer ML, Albrecht A, Moreno P et al. Técnica cirúrgica simplificada pode ser eficaz no tratamento da fibrilação atrial crônica secundária a lesão valvar mitral? Rev Bras Cir Cardiovasc 2000;15:129-35.
[ Lilacs ] [ SciELO ]
8. Coumel P, Aigueperse J, Perrault MA, Fantoni A, Scama R, Bouvrain Y. Reperrage et tentative d' exerese chirurgicale d'un foyer ectopique auriculaire gauche avec tachycardie rebelle: evolution favorable. Ann Cardiol Angeiol 1973;22:189-99.
9. Williams JM, Ungerleider RM, Lofland GK, Cox JL. Left atrial isolation: new technique for the treatment of supraventricular arrhythmias. J Thorac Cardiovasc Surg 1980;80:373-80.
[ Medline ]
10. Wyndham CR, Arnsdorf MF, Levitsky S, Smith TC, Dhingra RC, Denes P et al. Successful surgical excision of focal paroxysmal atrial tachycardia. Observations in vivo and in vitro. Circulation 1980;62:1365-72.
11. Graffigna A, Vigano M, Pagani F, Salerno G. Surgical treatment for ectopic atrial tachycardia. Ann Thorac Surg 1992;54:338-43.
[ Medline ]
12. Frame LH, Page RL, Boyden PA, Fenoglio Jr. JJ, Hoffman BF. Circus movement in the canine atrium around the tricuspid ring during experimental atrial flutter and during reentry in vitro. Circulation 1987;76:1155-75.
[ Medline ]
13. Dubost C, Guilmet D, de Parades B, Pedeferri G. New technique of opening of the left auricle in open-heart surgery: the transseptal bi-auricular approach. Presse Med 1966;74:1607-8.
14. Brick AV. Tratamento intraoperatório da fibrilação atrial crônica com ultra-som [Tese de Mestrado]. Belo Horizonte: Fundação Cardiovascular São Francisco de Assis, 2000.
15. Gomes OM, Pitchon M. Anuloplastia tricúspide parcial (1/4). Coração 1986;1:3.
16. Rauschel F. De arteriarum et venarum structura, Breslau, 1836. In: Burch GE, Romney RB. Functional anatomy and "throttle valve" action of the pulmonary veins. Am Heart J 1954;47:58-68.
17. Elischer J. Ueber quergestreifte muskeln der ins herz mündenden venen des menschen, 1869. In: Nathan H, Eliakim M. The junction between the left atrium and the pulmonary veins: an anatomic study of human hearts. Circulation 1966;34:412-22.
18. Rothberger CJ, Winterberg H. Uber vorhofflimmern und vorhofflattern, 1914. In: Cox JL, Schuessler RB, Boineau JP. The surgical treatment of atrial fibrillation. I. Summary of the current concepts of the mechanisms of atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991;101:402-5.
[ Medline ]
19. Lewis T. Observations upon flutter and fibrillation. Part IV. Impure flutter: theory of circus movement. Heart 1920;7:293-331.
20. Lewis T, Feil HS, Stroud WD. Observations upon flutter and fibrillation. Part II - The nature of auricular flutter. Heart 1920;7:191. In: Frame LH, Page RL, Boyden PA, Fenoglio JJ, Hoffman BF. Circus movement in the canine atrium around the tricuspid ring during experimental atrial flutter and during reentry in vitro. Circulation 1987; 76:1155-75.
[ Medline ]
21. Garrey WE. Auricular fibrillation. Physiol Rev 1924;4:215-50.
22. Josephson ME, Spear JF, Harken AH, Horowitz LN, Dorio RJ. Surgical excision of automatic atrial tachycardia: anatomic and eletrophysiologic correlates. Am Heart J 1982;104:1076-85.
[ Medline ]
23. Frame LH, Page RL, Boyden PA, Hoffman BF. A right atrial incision that stabilized reentry around the tricuspid ring in dogs. Circulation 1983;68(suppl III):III-361.
24. McCarthy PM, Castle LW, Maloney JD, Trohman RG, Simmons TW, White RD et al. Initial experience with the maze procedure for atrial fibrillation. J Thorac Cardiovasc Surg 1993;105:1077-87.
[ Medline ]
25. Jatene MB, Sosa E, Jatene FB, Tarasoutchi F, Monteiro AC, Salerno PR et al. Evolução tardia da operação de Cox para fibrilação atrial em valvopatia mitral. Rev Bras Cir Cardiovasc 1995;10:18-24.
[ Lilacs ]
26. Kawaguchi AT, Kosakai Y, Sasako Y, Eishi K, Nakano K, Kawashima Y. Risks and benefits of combined maze procedure for atrial fibrillation associated with organic heart disease. J Am Coll Cardiol 1996;28:985-90.
[ Medline ]
27. Brick AV, Seixas T, Peres A, Vieira Jr. JJ, Mattos JV, Mesquita A et al. Reversão da fibrilação atrial crônica pela técnica do labirinto com aplicação de radiofreqüência e ultra-som transoperatórios. Rev Bras Cir Cardiovasc 1999;14:290-7.
[ Lilacs ] [ SciELO ]
28. Wanderlei Neto J. Tratamento cirúrgico da fibrilação atrial. In: 30º Congresso Nacional de Cirurgia Cardíaca / Simpósio DEPEX-SBCCV. Goiânia: Sociedade Brasileira de Cirurgia Cardiovascular; 2003.
29. Bath PS (Conference discussion. Appendix A) In: Benussi S, Pappone C, Nascimbene S, Oreto G, Caldarola A, Stefano PL et al. A simple way to treat chronic atrial fibrillation during mitral valve surgery: the epicardial radiofrequency approach. Eur J Cardiothoracic Surg 2000;17:524-9.
30. Robbins IM, Colvin EV, Doyle TP, Kemp WE, Loyd JE, McMahon WS et al. Pulmonary vein stenosis after catheter ablation of atrial fibrillation. Circulation 1998;98:1769-75.
[ Medline ]
31. Chiappini B, Martìn-Suàrez S, LoForte A, Arpesella G, Di Bartolomeo R, Marinelli G. Cox/Maze III operation versus radiofrequency ablation for the surgical treatment of atrial fibrillation: a comparative study. Ann Thorac Surg 2004;77:87-92.
[ Medline ]
32. Cox JL. Atrial fibrillation II: rationale for surgical treatment. J Thorac Cardiovasc Surg 2003;126:1693-9.
[ Medline ]


 All scientific articles published at www.rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at www.rbccv.org.br are licensed under a Creative Commons license